Përmbledhur dhe përshtatur në shqip nga:
- Aldi Pupuleku, PhD
Recensente:
- Teuta Muhollari, PhD (c)
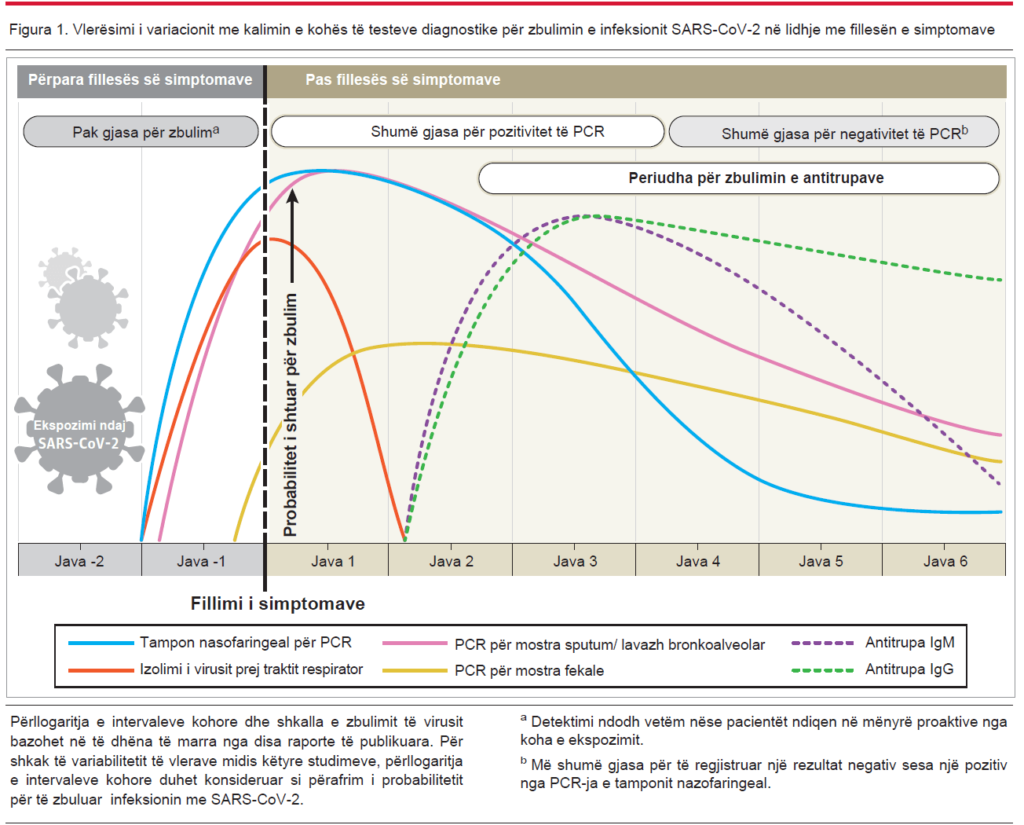
Pandemia e sëmundjes COVID-19 e shkaktuar nga virusi SARS-CoV-2 vazhdon ende të influencojë pjesën më të madhe të botës. Njohuritë mbi testet diagnostikuese për këtë sëmundje janë duke evoluar nga dita në ditë, kështu që është shumë e rëndësishme të kuptohet qartë natyra dhe interpretimi i tyre. Kjo përmbledhje përshkruan mënyrën se si duhen interpretuar 2 llojet e testeve në përdorim më të zakonshëm për diagnostikimin e SARS-CoV-2 dhe si rezultatet mund të ndryshojnë me kalimin e kohës. RT-PCR-ja (reverse transcriptase-polymerase chain reaction) detekton materialin gjenetik të virusit ndërsa testet serologjike përcaktojnë praninë e imunoglobulinave M dhe G (IgM dhe IgG) (Figura 1).
1. Detektimi i ARN-së virale ( materialit gjenetik të virusit) me RT-PCR
Aktualisht, testi më i përdorur dhe më i besueshëm për diagnostikimin e COVID-19 është ai i RT-PCR-së, i cili realizohet duke përdorur tamponet nazofaringeale, specimenet ( kampion/mostër) e traktit të sipërm respirator dhe së fundmi edhe pështymën. Baza e këtij testi është amplifikimi i gjeneve (rritja e kopjeve të numrit të një gjeni të caktuar pa nevojën e rritjes proporcionale të numrit të gjeneve të tjera) të ndryshme virale, si: ato që kodojnë për:
- pjesën mbështjellëse (envelope = env), nukleokapsidin(N), proteinën “spike” (gjilpërë = S),
- polimerazën e ARN-së (RdRp) dhe
- gjenet e ORF1 (open reading frame 1).
Sensitiviteti i testeve për gjenet individualë është i krahasueshëm bazuar në krahasimet që vijnë prej studimeve të ndryshme. Përjashtim bën RdRp-ja e cila ka një sensitivitet (Se) pak më të ulët. Gjithsesi, nisur nga kjo perspektivë mund të thuhet se (Se) i testeve që kanë si target këto gjene është thuajse i barazvleshëm1.
Në shumicën e individëve që paraqiten me infeksion simptomatik të COVID-19, ARN-ja virale e matur me cycle threshold (Ct) bëhet e detektueshme që në ditën e parë të simptomave dhe arrin maksimumin brenda javës. Ct është numri i cikleve të replikimit që kërkohet për të prodhuar një sinjal fluoreshent dhe vlerat më të ulëta të Ct-së përfaqësojnë ngarkesën më të lartë të ARN-së virale. Një vlerë Ct-je më pak se 40 raportohet klinikisht si PCR pozitive. Ky pozitivitet fillon e bie nga java e tretë dhe më pas bëhet i padukshëm. Megjithatë, një PCR pozitive pasqyron vetëm zbulimin e ARN-së virale dhe nuk tregon domosdoshmërisht praninë e një virusi me kapacitet infektues2.
Në disa raste, ARN-ja virale është zbuluar prej PCR edhe pas javës së 6-të (në këtë rast, referencë merret testi i parë pozitiv). Gjithashtu në disa raste të rralla, janë raportuar rezultate pozitive edhe pas 2 testeve të njëpasnjëshme negative të kryera 24 orë larg njëri-tjetrit. Nuk është ende e qartë nëse ky është:
- një gabim në testim,
- një ri-infeksion apo
- një riaktivizim i virusit.
Në një studim me 9 pacientë, përpjekjet për të izoluar virusin në kulturë përtej ditës së 8-të të shfaqjes të sëmundjes (e cila përkon gjithashtu me rënien e infeksiozitetit përtej javës së parë) nuk ishin të suksesshme2. Kjo është arsyeja pse “strategjia e bazuar në simptoma” e Qendrave për Kontrollin dhe Parandalimin e Sëmundjeve në SHBA, këshillon që punonjësit e kujdesit shëndetësor mund të kthehen në punë vetëm nëse kanë kaluar të paktën 3 ditë (72 orë) që nga shërimi (i përcaktuar si ‘kalim i temperaturës’ pa përdorur barna për uljen e saj dhe përmirësimin e simptomave të frymëmarrjes si kollë dhe gulçim) dhe të paktën 10 ditë nga shfaqja e parë e simptomave3.
Kohëzgjatja e pozitivitetit të PCR-së varion në specimene (kampione/mostra) të ndryshme krahasuar me tamponin nazofaringeal. Pozitiviteti i PCR-së bie më ngadalë në pështymë dhe mund të jetë akoma pozitiv edhe pse tamponet e nazofaringeale mund të rezultojnë negative2. Në një studim, pozitiviteti i PCR-së në jashtëqitje u vërejt në 55 nga 96 (57%) pacientë të infektuar dhe mbeti pozitiv mesatarisht nga 4 në 11 ditë krahasuar me atë të tamponit nazofaringeal, por nuk kishte lidhje me ashpërsinë klinike4. Qëndrueshmëria e rezultateve të PCR-së në pështymë dhe jashtëqitje u panë të ishin të ngjashme siç vlerësohej edhe nga Wölfel et al2.
Në një studim ku u përfshinë 205 pacientë me infeksion të konfirmuar, pozitiviteti i PCR-së ishte më i lartë në specimenet e lavazhit bronkoalveolar (93%), i ndjekur nga pështyma (72%), tamponi i hundës (63%) dhe tamponi faringut (32%)5. Rezultatet fals-negative (FN) kryesisht ndodhën për shkak të kohës së papërshtatshme të mbledhjes së mostrave në lidhje me fillimin e sëmundjes dhe mangësive teknike gjatë marrjes së mostrave, veçanërisht të tamponeve nazofaringeale. Specificiteti i testeve RT-PCR është 100% sepse primer-at janë dizenjuar për të detektuar dhe amplifikuar vetëm sekuencën e gjenomit SARS-CoV-2. Rezultatet fals-pozitive (FP) okazionale (të veçanta) mund të ndodhin për shkak të gabimeve teknike dhe ndotjes së reagentit ose mostrës.
2. Detektimi i antitrupave kundër SARS-CoV-2
Statusi mbi infeksionin COVID-19 mund të zbulohet gjithashtu në mënyrë indirekte duke matur përgjigjen imunitare të personit të infektuar ndaj infeksionit të shkaktuar prej SARS-CoV-2. Diagnostikimi serologjik është veçanërisht i rëndësishëm për pacientët me sëmundje të butë dhe të moderuar, të cilët mund të paraqiten për të bërë testin edhe përtej 2 javëshit të para të fillimit të sëmundjes. Diagnostikimi serologjik po bëhet gjithashtu një mjet i rëndësishëm për të kuptuar shtrirjen e COVID-19 në komunitet dhe për të identifikuar individët që janë imunë dhe potencialisht “të mbrojtur” nga infektimi.
Markerat serologjik më të ndjeshëm dhe më të hershëm janë antitrupat totalë, nivelet e të cilëve fillojnë të rriten nga java e dytë pas shfaqjes së simptomave6. Edhe pse IgM-të dhe IgG-të rezultojnë pozitivë që në ditën e katërt pas simptomave, nivele më të larta detektohen në javën e dytë dhe të tretë të sëmundjes. Për shembull, serokonversioni (ndryshimi prej seronegativitetit në seropozitivitet) i IgM dhe IgG u vërejt në të gjithë pacientët midis javës së tretë dhe të katërt të fillimit të sëmundjes (To et al7 dhe Xiang et al8). Pas kësaj, IgM-të fillojnë të bien dhe arrijnë nivelet më të ulëta në javën e 5-të dhe pothuajse zhduken gjatë javës së 7-të, ndërsa IgG-të vazhdojnë të jenë të detektueshme përtej javës së 7-të9.
Testet e antitrupave IgM dhe IgG me teknikën ELISA (enzyme-linked immunosorbent assay) kanë specificitet më të madh se 95% për diagnostikimin e COVID-19. Zakonisht, shumica e antitrupave prodhohen kundër proteinës më të bollshme të virusit, që është ajo e nukleokapsidit (NC). Prandaj, testet që zbulojnë antitrupat ndaj nukleokapsidit do të kishin ndjeshmërinë më të lartë. Sidoqoftë, domaini i proteinës S që lidh receptorin (RBD-S) është pjesa kyçe e hyrjes tek qelizat e mbartësit, dhe antitrupat ndaj RBD-S do të jenë më specifik dhe mundësisht neutralizues. Prandaj, përdorimi i një ose të dy antigjenëve për zbulimin e IgG dhe IgM do të rezultonte në një ndjeshmëri të lartë7.
Testet e shpejta serologjike për zbulimin e antitrupave janë zhvilluar dhe tregëtuar gjerësisht, por shumë prodhues nuk bëjnë të ditur natyrën e antigjeneve të përdorura në to. Gjithsesi, këto teste tregojnë vetëm praninë ose mungesën e antitrupave kundër SARS-CoV-2. Nëse realisht antitrupat e detektuar kanë efekte neutralizuese mund të konfirmohet vetëm me eksperimente plotësuese. Për momentin qëndrueshmëria afatgjate dhe kohëzgjatja e mbrojtjes së dhënë nga antitrupat neutralizues mbetet e panjohur.
Konkluzionet
Duke përdorur evidencat e disponueshme aktualisht, u hartua një grafik klinikisht i dobishëm në lidhje me intervalet kohore të markerave diagnostikues për zbulimin e COVID-19 (Figura 1). Shumica e të dhënave në dispozicion i referohen popullsisë së rritur imuniteti i të cilëve nuk është i kompromentuar. Këto të dhëna mund të ndryshojnë tek fëmijët dhe grupe të tjera, përfshirë këtu edhe popullsinë e madhe të individëve asimptomatikë që nuk diagnostikohen. Gjithsesi shumë pyetje mbeten akoma pa përgjigje, veçanërisht përsa i përket kohëzgjatjes së imunitetit të mundshëm tek të dy llojet e individëve, asimptomatikë dhe simptomatikë, të cilët janë të infektuar me SARS-CoV-2.
Artikulli origjinal:
Sethuraman N, Jeremiah SS, Ryo A. Interpreting Diagnostic Tests for SARS-CoV-2. JAMA, 6 maj 2020.